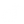 |
Ureyim.az |
Kovalent rabitə — Elektromənfilikləri az fərqlənən atomlar arasında kovalent rabitə yaranır. Kovalent rabitənin təbiəti atomlar cütünün ümumi (əlaqələndirici) elektron cütü əmələ gətirməsindən və bu cütə birgə sahib olmasından ibarətdir. Bu cütlüyün elektronları hesabına hər bir atom öz xarici elektron səviyyəsini tamamlayır və bununla da öz enerjisini azaldır. Bu cütün yerləşdiyi yerdə mənfi yükün iki qat olması hesabına nüvələrdən hər birinin arasında və bu oblastda cazibə güclənir. Beləliklə atomlar əlaqələnmiş olur və birlikdə olur.


Rabitə ilə bağlı kovalentlik termini ilk dəfə 1919-cu ildə Amerika Kimya Cəmiyyətinin jurnalında İrvinq Lenqmuir tərəfindən "Atomlarda və Molekullarda elektronların düzülüşü" adlı məqalədə istifadə edilmişdir. Lenqmur yazırdı ki, “biz kovalentlik termini ilə müəyyən bir atomun qonşuları ilə paylaşdığı elektron cütlərinin sayını ifadə edəcəyik”.
Kovalent rabitə ideyası 1919-cu ildən bir neçə il əvvəl 1916-cı ildə atomlar arasında elektron cütlərinin bölüşdürülməsini təsvir edən Gilbert N. Lewis-ə aid edilə bilər (və 1926-cı ildə o, həmçinin şüalanma enerjisinin ən kiçik vahidi üçün "foton" terminini istifadə etdi). O, Lyuis notasiyasını və ya elektron nöqtə notasiyasını və ya valent elektronların (xarici təbəqədə olanlar) atom simvolları ətrafında nöqtələr kimi təmsil olunduğu Lyuis nöqtə quruluşunu təqdim etdi. Atomlar arasında yerləşən elektron cütləri kovalent rabitələri təmsil edir. Çoxlu cütlər ikiqat və üçqat kimi rabitələri təmsil edir.
Lewis, bir atomun tam (və ya qapalı) xarici elektron təbəqəsi meydana gətirmək üçün kifayət qədər kovalent rabitə meydana gətirdiyini təklif etdi. Burada göstərilən metanın diaqramında karbon atomunun dörd valentliyi var və buna görə də səkkiz elektron (oktet qaydası), dördü karbonun özündən və dördü isə ona bağlanmış hidrogenlərdən dördü ilə əhatə olunub. Hər bir hidrogenin bir valentliyi var və iki elektron (duplet qaydası) ilə əhatə olunmuşdur - öz bir elektronu və karbondan bir elektron. Elektronların sayı atomun kvant nəzəriyyəsində tam təbəqələrə uyğundur; karbon atomunun xarici təbəqəsi səkkiz elektron saxlaya bilən n = 2 təbəqəsidir, hidrogen atomunun xarici (və yeganə) təbəqəsi isə yalnız ikisini saxlaya bilən n = 1 təbəqəsidir.
Ortaq elektron cütləri ideyası kovalent rabitələrin effektiv keyfiyyət mənzərəsini təqdim etsə də, bu rabitələrin təbiətini anlamaq və sadə molekulların strukturlarını və xassələrini proqnozlaşdırmaq üçün kvant mexanikasına ehtiyac var. Walter Heitler və Fritz London 1927-ci ildə kimyəvi rabitələrin (molekulyar hidrogen) ilk uğurlu kvant mexaniki izahını vermişdir. Onların işi, iştirakçı atomların atom orbitalları arasında yaxşı üst-üstə düşən zaman kimyəvi rabitənin yarandığını güman edən valent rabitə modelinə əsaslanırdı.
Kovalent rabitənin əmələ gəlməsinin iki mexanizmi mümkündür:
Kovalent əlaqə polyar və qeyri-polyar olur. O əlaqə polyar adlanır ki, bu əlaqədə elektron sıxlığı daha çox elektromənfi atoma doğru yerini dəyişir. Qeyri-polyar əlaqə əmələ gəldikdə belə yerdəyişmə olmur. Polyarlaşma nisbi elektromənfilikləri müxtəlif qiymətlərə malik olan element atomları arasında əlaqə yarandıqda baş verir. Çox vaxt kovalent əlaqə elektron cütünü ifadə edən xətt (–) ilə ifadə olunur. Məsələn, H–H, H–Cl, H–O–H Əlaqənin belə ifadəsi ilə alınan yazı struktur formulu adlanır. Atom onun valent səviyyələrində olan ümumi orbitalların sayından çox kovalent əlaqələr yarada bilməz.[1]
Atom orbitalları (s orbitalları istisna olmaqla) müxtəlif növ kovalent rabitələrə səbəb olan xüsusi istiqamət xüsusiyyətlərinə malikdir. Siqma (σ) rabitələr ən güclü kovalent rabitələrdir və iki fərqli atomdakı orbitalların üst-üstə düşməsi nəticəsində yaranır. Təkqat rabitə adətən σ rabitədir. Pi (π) rabitsi daha zəifdir və p (və ya d) orbitalları arasında yanaşı üst-üstə düşmə ilə bağlıdır. Verilmiş iki atom arasındakı ikiqat rabitədən biri σ və biri π rabitəsindən, üçlü rabitə isə bir σ və iki π rabitəsindən ibarətdir.
Kovalent rabitələrə, rabitənin kimyəvi polyarlığını təyin edən əlaqəli atomların elektronmənfiliyi də təsir göstərir. Elektromənfiliyi bərabər olan iki atom H-H kimi qeyri-polyar kovalent bağ yaradacaq. Qeyri-bərabər əlaqə H−Cl ilə olduğu kimi polyar kovalent bağ yaradır. Bununla belə, qütbləşmə (polyarlaşma) həndəsi asimmetriyanı da tələb edir, əks halda dipollar ləğv oluna bilər və nəticədə qeyri-polyar molekul yaranır.
Tək bir Lyuis strukturunun molekuldakı elektron konfiqurasiyasını və nəticədə eksperimental olaraq müəyyən edilmiş xassələrini izah etmək üçün kifayət etmədiyi vəziyyətlər var, buna görə də strukturların superpozisiyasına ehtiyac var. Belə molekullardakı eyni iki atom müxtəlif Lyuis strukturlarında fərqli şəkildə bağlana bilər (birində tək rabitə, digərində ikiqat rabitə və ya ümumiyyətlə heç biri), nəticədə tam ədəd olmayan rabitə tərtibi yaranır. Nitrat ionu üç ekvivalent quruluşa malik belə bir nümunədir. Azot və hər bir oksigen arasındakı rabitə bir quruluşda ikiqat, digər ikisində isə təkqatdır, beləliklə, hər bir N-O qarşılıqlı əlaqəsi üçün orta rabitə tərtibi: 2 + 1 + 1/3 = 4/3
Üzvi kimyada müstəvi halqalı molekul Hükel qaydasına tabe olduqda, hansı ki π elektronların sayı 4n + 2 düsturuna uyğundur (burada n tam ədəddir), əlavə sabitlik və simmetriya əldə edir. Prototip aromatik birləşmə olan benzolda 6 π bağlayıcı elektron var (n = 1, 4n + 2 = 6). Bunlar üç delokalizasiya olunmuş (ümumiləşmiş) π molekulyar orbitalı tutur (molekulyar orbital nəzəriyyəsi (MON)) və ya xətti birləşən iki rezonans strukturunda konyuqə π bağları əmələ gətirir (valent rabitə nəzəriyyəsi), 1,3,5-sikloheksatriendən daha böyük davamlılıq nümayiş etdirir və düzgün altıbucaqlı yaradır.[9]
Heterosiklik aromatiklər və əvəz edilmiş benzollar halında, halqanın müxtəlif hissələri arasında elektronmənfilik fərqləri aromatik halqa rabitələrinin kimyəvi davranışında böyük fərq yarada bilər, amma əks halda bərabərdirlər.
Kimya haqqında olan bu məqalə bu məqalə qaralama halındadır. Məqaləni redaktə edərək Vikipediyanı zənginləşdirin. |